- 「水よう液の性質」の過去問を知りたい
- 今からでも点数が上がる勉強方法を教えて
こんな思いに応えます。
五木模試の過去問があれば、勉強しやすいのにって思うことありますよね。
実は『水よう液の性質』は特別回の五木模試で必ず出題されるのはご存知でしょうか。
この記事では「水よう液の性質」に関する過去問を集めていますので、効率的に五木模試対策を行うことができます。

応援ねこ
なお、全7回の出やすい問題も解説しています。
過去の出題傾向も目を通しておくことをオススメします。
この記事を読むことで
- 「水よう液の性質・酸性とアルカリ性の中和」の過去問で実力の確認ができる
- 要点を先取りして知れるので、いろんな参考書に手を出す必要がなくなる
- どこから手をつけたらよいか分からない状態から抜け出せる
「水よう液の性質・酸性とアルカリ性の中和」だけを学べます。
ちょっとした時間でも一問一答形式で解くこともできます。
先取り学習と時短で、賢く点数UPしちゃいましょう。

応援ねこ
五木模試過去問「水よう液の性質・酸性とアルカリ性の中和」学習内容
「水よう液の性質・酸性とアルカリ性の中和」は、特別回の五木模試で出題され、次の内容を学習します。
「水よう液の性質・酸性とアルカリ性の中和」の学習内容
- 「水酸化ナトリウム水よう液に塩酸を加える」場合と、「塩酸に水酸化ナトリウム水よう液を加える」場合の現象の違い
- 水酸化ナトリウム水よう液に塩酸を加え、中和反応でできた食塩の重量増加と水酸化ナトリウムの重量減少
- 塩酸に水酸化ナトリウム水よう液を加え、中和反応でできた食塩の重量増加と中和反応以降の水酸化ナトリウムの重量増加
過去問で勉強することで要点をつかみ、模試本番でも答えられるようにしておきましょう。
 ポチップ
ポチップ
五木模試過去問「水よう液の性質・酸性とアルカリ性の中和」2選
「水よう液の性質/酸性とアルカリ性の中和」について五木模試の過去問を2題集めています。
- 水酸化ナトリウム水よう液に塩酸を加える中和
- 塩酸に水酸化ナトリウム水よう液を加える中和
水酸化ナトリウム水よう液に塩酸を加える中和
2019年の『第5回』五木模試に出題された「水酸化ナトリウム水よう液に塩酸を加える中和」に関する過去問を解説します。
問題数4問、解答数5問。合計16点。
問題1-1
水酸化ナトリウム
水よう液20cm3入ったビーカーを
たくさん用意し、
それぞれにいろいろな体積の
うすい塩酸Bを加えた。
反応が終わった後に
加熱して水を蒸発させ
残った固体の重さを測定した。
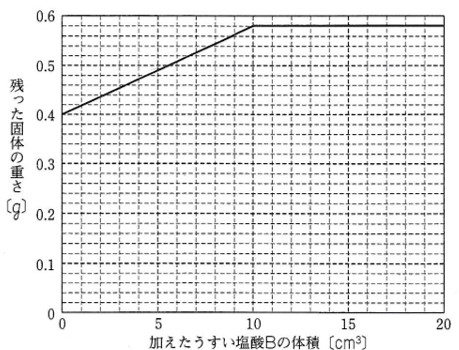
グラフは、
加えたうすい塩酸Bの体積と
水を蒸発させた後に残った
固体の重さとの関係を
表したものです。

水酸化ナトリウム水よう液
10cm3の中には、
何gの水酸化ナトリウムが
とけていますか。
解説を見る
グラフより、うすい塩酸Bを加えていないとき、水を蒸発させて残った固体の重さが0.4gになっている。
水酸化ナトリウム水よう液A20cm3にとけている水酸化ナトリウムの重さが0.4gであることがわかる。
水酸化ナトリウム水よう液A10cm3の中にとけている水酸化ナトリウムの重さを口gとすると、
20:10 = 0.4:ロ
ロ= 0.2 ( g )
加えたうすい塩酸の体積が0cm3は、水酸化ナトリウム水よう液だけという意味だよ

応援ねこ
問題1-2
この実験で
うすい塩酸Bを5cm3を加えた。
水を蒸発させた後に残った
固体の中にふくまれている
食塩(塩化ナトリウム)と
水酸化ナトリウムの重さは
それぞれ何gですか。
答えをチェック
食塩:0.29(g)
水酸化ナトリウム:0.2(g)
(4点×2=8点)
解説を見る
うすい塩酸B10cm3加えたときに残った固体の重さは、グラフから0.58gと読み取れる。
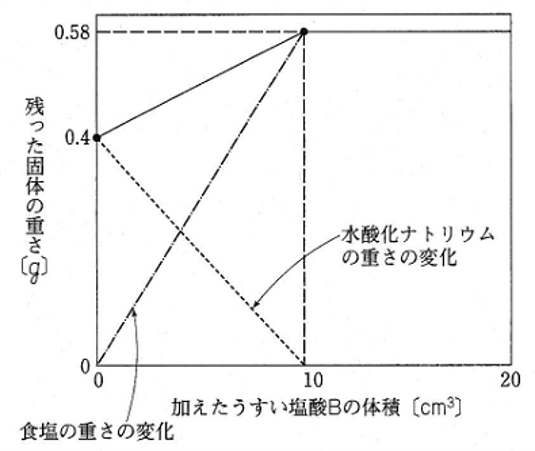
このことから、うすい塩酸と水酸化ナトリウム水よう液の反応によってできる食塩(塩化ナトリウム)の重さと、反応によって減少する水酸化ナトリウムの重さは、下のグラフのように変化する。

うすい塩酸B 10cm3を加えたとき、残った食塩の重さは0.58g。
うすい塩酸B 5cm3を加えたときにできる食塩の重さを口gとすると、
10 : 5 = 0.58:ロ
ロ= 0.29 (g)
水酸化ナトリウム水よう液10cm3のとき(うすい塩酸B 0cm3のとき)は水酸化ナトリウムの重さは0.4g。
うすい塩酸B 5cm3加えたとき、残っている水酸化ナトリウムの重さを△gとすると、
10 : ( 10ー5 ) = 0.4 : △
△ = 0.2 (g)
うすい塩酸を加えることで水酸化ナトリウム水よう液と中和反応が起きる
固体の重さが変化しなくなったところは、すべての水酸化ナトリウム水よう液が塩酸と完全に中和したところになるよ

応援ねこ
問題1-3
水酸化ナトリウム
水よう液12cm3に
うすい塩酸9cm3を加えた。
緑色のBTBよう液を加えると
何色になりますか。
ア 緑色
イ 黄色
ウ 赤色
エ 青色
解説を見る
グラフは、水酸化ナトリウム水よう液A20cm3にうすい塩酸Bの加える体積を増やしていったときに残った固体の重さの変化を表す。
うすい塩酸B10cm3を加えたところで残った固体の重さが変化しないことから、
水酸化ナトリウム水よう液A20cm3 とうすい塩酸B10cm3が過不足なく中和反応したことが分かる。
問題の水酸化ナトリウム水よう液A12cm3の場合を考えたら良い。
反応する塩酸Bの体積を口cm3とすると、
20:12 = 10:ロ
ロ= 6 (cm3)
したがって、うすい塩酸B 9ー6 = 3 (cm3)分にとけている塩化水素が反応せずに残るので、酸性となる。
BTBよう液は
酸性で黄色、
中性で緑色,、
アルカリ性で青色を示す。
水酸化ナトリウム水溶液とうすい塩酸が中和するときの体積割合を求める
中和する体積割合よりも多いよう液は中和反応せずに残る
中和反応せずに残ったよう液が何性かを調べる方法としてBTBよう液がある
BTBよう液は、酸性:黄色、中性:緑色、アルカリ性:青色になる

応援ねこ
問題1-4
水酸化ナトリウム
水よう液40cm3に
うすい塩酸10cm3を加えた。
水を蒸発させた後に残った
固体の重さは何gですか。
解説を見る
グラフは、水酸化ナトリウム水よう液A20cm3にうすい塩酸Bの加える体積を増やしていったときに残った固体の重さの変化を表す。
水酸化ナトリウム水よう液A20cm3 とうすい塩酸B10cm3が過不足なく反応し食塩0.58gができる。
このとき、水酸化ナトリウム水よう液Aは、40ー20 = 20 (cm3)中和せずにあまる。
水酸化ナトリウム水よう液A20cm3にとけている水酸化ナトリウムの重さは0.4g。
水を蒸発させた後に残った固体全体の重さは、水酸化ナトリウムと食塩の合計となり、
0.58 + 0.4 = 0.98 (g)
水酸化ナトリウム水よう液とうすい塩酸の中和によってできた食塩の量と、
中和せずに残った水酸化ナトリウム水よう液に溶けている水酸化ナトリウムの量を
それぞれ求めることが必要だね

応援ねこ
「水酸化ナトリウム水よう液に塩酸を加える中和」の五木模試過去問を解説しました。基礎を定着させるために、学んだことを復習しておきましょう。
水酸化ナトリウム水よう液に塩酸を加える中和
- 加えた塩酸の体積が0cm3の意味は、塩酸を加えておらず水酸化ナトリウム水よう液だけ
- 塩酸を加えることで水酸化ナトリウム水よう液と中和反応でできた食塩の重量変化を読み取る
- すべての水酸化ナトリウム水よう液が塩酸と完全に中和したあとは食塩の重量は増えない
- 中和する体積割合を求めることで、中和反応せずに残った水よう液が何かを知ることができる
- 水よう液が何性かを調べる方法としてBTBよう液があり、酸性:黄色、中性:緑色、アルカリ性:青色になる
塩酸に水酸化ナトリウム水よう液を加える中和
平成30年の『第6回』五木模試に出題された「塩酸に水酸化ナトリウム水よう液を加える中和」に関する過去問を解説します。
問題数5問、解答数7問。合計18点。
問題2-1
うすい塩酸(A液)10cm3を入れた
6つの蒸発皿①~⑥を用意した。
それぞれにうすい
水酸化ナトリウム水よう液(B液)を
5cm3、10cm3、15cm3、
20cm3、25cm3、30cm3加えた。
反応後に水分をすべて蒸発させ
残った固体の重さをはかった。
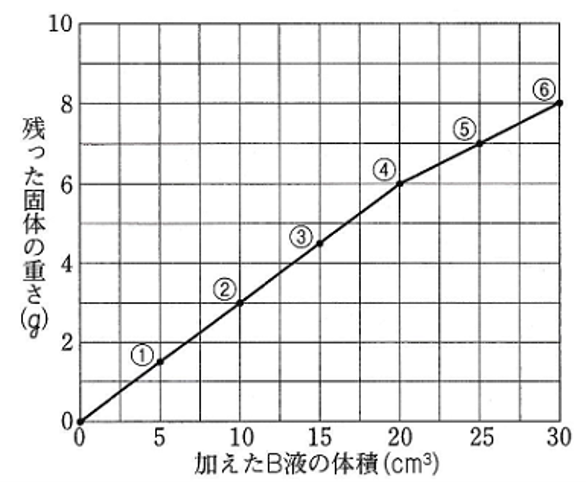
図は、
加えたB液の体積と
残った固体の重さとの関係を
グラフに表したものです。

B液を加えたとき、
反応後の水よう液が
酸性になるものはどれですか。
①~⑥からすべて選びなさい。
解説を見る
グラフは、④からかたむきが変わっているので、④のA液10cm3とB液20cm3のときに過不足なく中和して中性になったと考える。
①・②・③ではA液(うすい塩酸)が残っているので酸性を示し、
⑤・⑥ではB液(うすい水酸化ナトリウム水よう液)が残っているのでアルカリ性を示す。
酸性の塩酸に少量の水酸化ナトリウム水よう液を加えると
中和反応により食塩ができるが塩酸が残っていると酸性のまま。
水酸化ナトリウム水よう液をさらに加えると過不足なく中和し中性になる。
さらに水酸化ナトリウム水よう液を加えても中和反応せず、水酸化ナトリウム水よう液のアルカリ性を示す。

応援ねこ
問題2-2
②、⑤の反応後に
水分をすべて蒸発させた。
蒸発皿の上には何が残りますか。
次からそれぞれ選びなさい。
ア 塩化水素のみ
イ 塩化水素と食塩
ウ 食塩のみ
工 塩化水素と水酸化ナトリウム
オ 水酸化ナトリウムのみ
カ 食塩と水酸化ナトリウム
答えをチェック
②:ウ 食塩のみ
⑤:カ 食塩と水酸化ナトリウム
(2点×2=4点)
解説を見る
②の水よう液の中には中和によってできた食塩と反応できなかった塩化水素が残ってるが、塩化水素は気体なので水といっしょに蒸発する。
よって、食塩だけが残る。
⑤の水よう液の中には中和によってできた食塩と反応できなかった水酸化ナトリウムが残っているので、水を蒸発させると食塩と水酸化ナトリウムが残る。
酸性の塩酸にアルカリ性の水酸化ナトリウム水よう液を加えると中和により食塩ができる
過不足なく中和したあとは、水酸化ナトリウム水よう液を加えてもそれ以上中和反応せず、水酸化ナトリウム水よう液が残った状態となる

応援ねこ
問題2-3
⑥の反応後に
水分をすべて蒸発させた。
残った固体の中にふくまれる
食塩の重さは何gですか。
ただし、
残った固体の中に
食塩がふくまれない場合は
0gと答えなさい。
解説を見る
グラフより、④の水よう液では食塩が6gできていることがわかる。
塩化水素はここでなくなるので、これ以上うすい水酸化ナトリウム水よう液を加えても、食塩の量は変わらない。
⑤、⑥の水よう液で残った固体の重さの増えた分は、反応できなかった水酸化ナトリウムの重さを示す。

応援ねこ
問題2-4
A液25cm3にB液を加えて
水よう液を中性にした。
加えたB液の体積は何cm3ですか。
反応後に水分をすべて蒸発させたとき、
出てくる食塩の重さは何gですか。
答えをチェック
B液:50(cm3)
食塩:15(g)
(2点×2=4点)
解説を見る
A液10cm3とB液20cm3が過不足なく中和しているので、
A液25cm3と過不足なく中和するB液の体積を口cm3とすると、
25:ロ= 10:20
ロ= 50 (cm3)
A液10cm3がすべて中和したときにできた食塩の重さが6gなので、A液25cm3がすべて中和したときにできる食塩の重さを△gとすると
6 : △ = 10 : 25
△ = 15 (g)
過不足なく中和する塩酸と水酸化ナトリウム水よう液の体積比率は一定だよ
中和反応でできる食塩の量は水よう液の体積が増えるほど多くなるよ

応援ねこ
問題2-5
A液20cm3にB液50cm3を加え、
反応後に水分をすべて蒸発させた。
残った固体の重さは何gですか。
解説を見る
A液20cm3と過不足なく中和するB液の体積を口 cm3とすると、
20:ロ= 10 : 20
ロ= 40 ( crn3)
このときできる食塩の重さを△ gとすると、
6 : △ = 10 : 20
△ = 12 ( g )
このときB液10cm3分にとけていた水酸化ナトリウムが中和せず残る。
グラフで、④のB 液20cm3を加えたあとは水酸化ナトリウムが中和せずに残るので、
④と⑥での残った固体の重さの差である2 g ( 8ー6 = 2 )は,、
④と⑥での加えたB液の差であるB液10cm3 (30ー20 = 10)にとけていた水酸化ナトリウムの重さであることがわかる。
したがって、このとき残った固体の重さは、食塩+水酸化ナトリウム=12+2=14(g)
水よう液を混ぜ合わせる場合、過不足なく中和する塩酸と水酸化ナトリウム水よう液の体積を求める。
中和する量よりも多く混ぜた水よう液が、塩酸か水酸化ナトリウム水よう液のどちらかを知る。
中和反応後の水分を蒸発させたときに残るのは食塩。
水酸化ナトリウム水よう液が残っている場合、水分を蒸発させたら水酸化ナトリウムが残る。

応援ねこ
「塩酸に水酸化ナトリウム水よう液を加える中和」の五木模試過去問を解説しました。基礎を定着させるために、学んだことを復習しておきましょう。
塩酸に水酸化ナトリウム水よう液を加える中和
- 酸性の塩酸に少量の水酸化ナトリウム水よう液を加えると中和反応により食塩ができる
- 水酸化ナトリウム水よう液を加えても塩酸が残っていれば酸性のまま
- 水酸化ナトリウム水よう液をさらに加えると過不足なく中和し中性になる
- さらに水酸化ナトリウム水よう液を加えても中和反応はしない
- このとき、水酸化ナトリウム水よう液のアルカリ性を示す
- 中和反応後の水分を蒸発させたときに残るのは食塩
- 中和反応でできる食塩の量は水よう液の体積が増えるほど多くなる
- 水酸化ナトリウム水よう液が残っている場合、水分を蒸発させたら水酸化ナトリウムが残る
- 過不足なく中和する塩酸と水酸化ナトリウム水よう液の体積比率は一定
- 体積比率を求めることで、中和する量よりも多く混ぜた水よう液を知ることができる
「水よう液の性質・酸性とアルカリ性の中和」まとめ
今回は五木模試で出題された小6理科学習範囲である「水よう液の性質・酸性とアルカリ性の中和」を過去問で学習しました。
- 水酸化ナトリウム水よう液に塩酸を加える中和
- 塩酸に水酸化ナトリウム水よう液を加える中和
五木模試の過去問を繰り返し復習することで苦手分野を一つでも克服しておきましょう。
 ポチップ
ポチップ